Comme nous l'avons vu dans la leçon 3.06, la pression s'accumule dans les grains pendant la torréfaction. Pendant la torréfaction, l'eau contenue dans les grains s'évapore pour former de la vapeur et les réactions chimiques produisent davantage de vapeur d'eau, de dioxyde de carbone et de petites quantités d'autres gaz. Ces gaz s'accumulent plus rapidement qu'ils ne peuvent s'échapper par les pores du grain, provoquant une augmentation de la pression à l'intérieur du grain.
La pression qui s'accumule peut modifier la vitesse de nombreuses réactions chimiques qui ont lieu pendant la torréfaction, accélérant de nombreuses réactions tout en ralentissant d'autres.
À haute pression, plus molécules de gaz sont entassés dans le même volume. Toute réaction qui se produit lorsqu'un de ces gaz molécules les collisions avec une autre molécule se produiront donc à un rythme plus rapide, en raison du taux de collisions plus élevé.
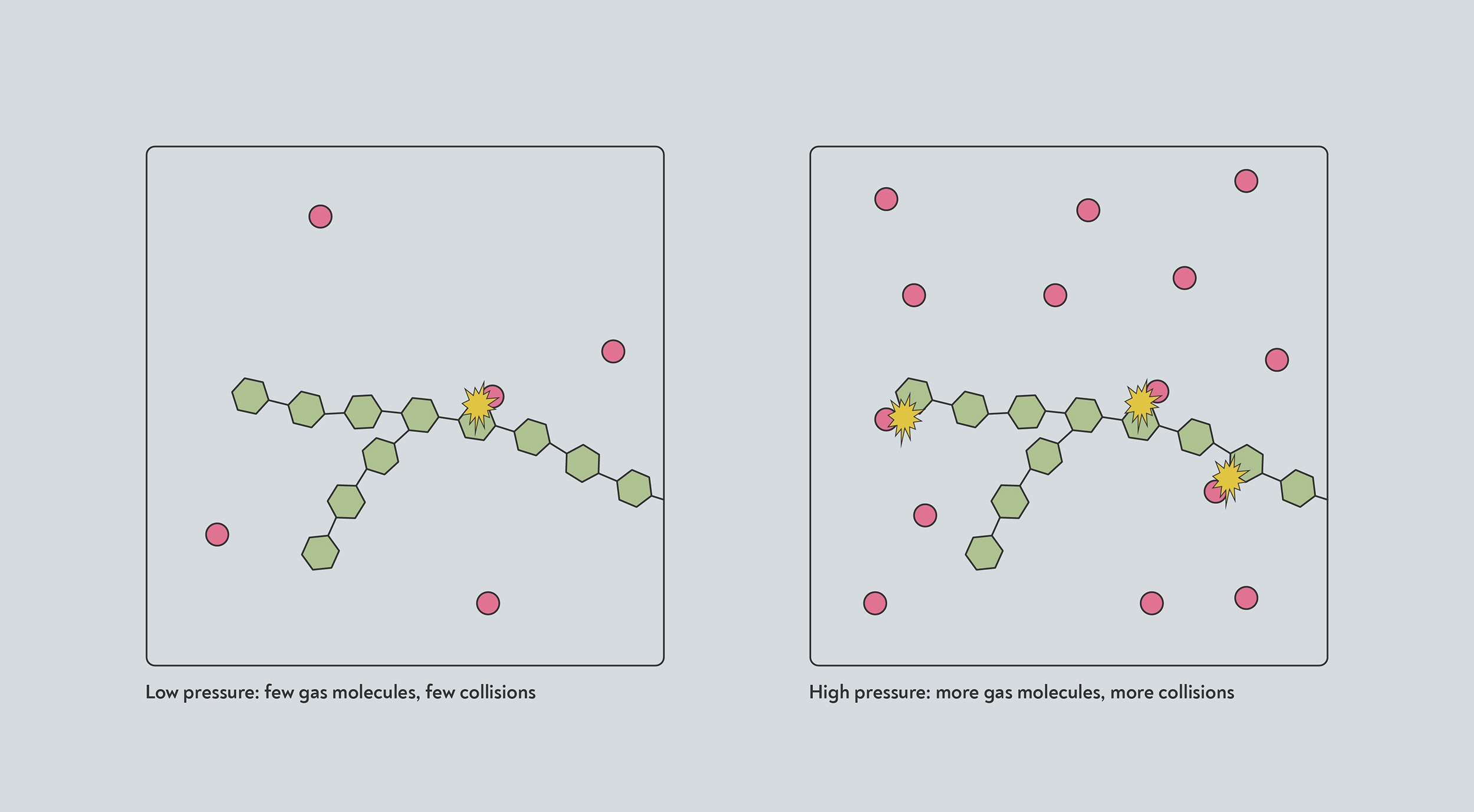 La haute pression augmente la vitesse de nombreuses réactions. À haute pression, plus de gaz molécules (rouge) occupent la même quantité d’espace. Ils sont donc plus susceptibles d'entrer en collision avec le solide (bleu) et de déclencher une réaction chimique.
La haute pression augmente la vitesse de nombreuses réactions. À haute pression, plus de gaz molécules (rouge) occupent la même quantité d’espace. Ils sont donc plus susceptibles d'entrer en collision avec le solide (bleu) et de déclencher une réaction chimique.
D'autres réactions peuvent être ralenties par la haute pression. Si un intermédiaire qui se forme au cours d'une réaction a un volume plus grand que les réactifs, alors la haute pression rend plus difficile la formation de cet intermédiaire, diminuant ainsi la vitesse de réaction (Chen et al. 2017). D’un autre côté, si l’intermédiaire a un volume plus petit, une pression élevée peut augmenter la vitesse de réaction.
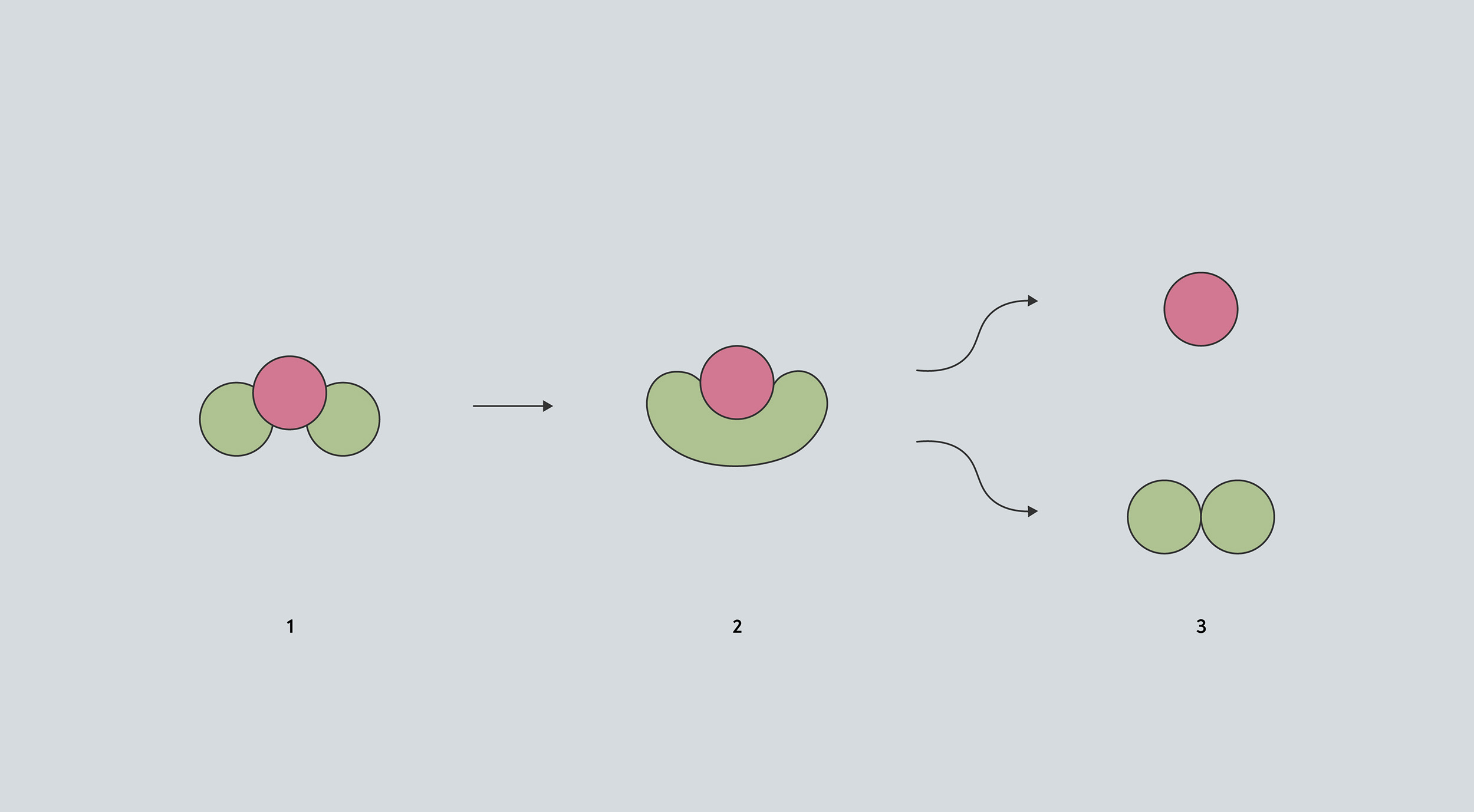 Dans ce schéma conceptuel d'une réaction, la molécule (1) doit passer par une étape intermédiaire (2) avant de pouvoir se décomposer pour former d'autres composés (3). L’étage intermédiaire a un volume plus grand que la molécule d’origine, donc une pression élevée rend plus difficile la formation de cet intermédiaire.
Dans ce schéma conceptuel d'une réaction, la molécule (1) doit passer par une étape intermédiaire (2) avant de pouvoir se décomposer pour former d'autres composés (3). L’étage intermédiaire a un volume plus grand que la molécule d’origine, donc une pression élevée rend plus difficile la formation de cet intermédiaire.
La chose importante à comprendre est que la pression augmente la vitesse de la plupart des réactions, mais que certaines réactions sont inhibées par une pression élevée. La pression peut également faire basculer le équilibre des réactions qui sont dans équilibre. Nous vous expliquerons équilibre réactions au chapitre 5.