Como discutimos en la Lección 3.06, se acumula presión en los granos durante el tostado. Durante el tueste, el agua de los granos se evapora para formar vapor y las reacciones químicas producen más vapor de agua, dióxido de carbono y pequeñas cantidades de otros gases. Estos gases se acumulan más rápido de lo que pueden escapar a través de los poros del frijol, lo que hace que aumente la presión dentro del frijol.
La presión que se acumula puede cambiar la velocidad de muchas reacciones químicas que tienen lugar durante el tueste, acelerando muchas reacciones y ralentizando otras.
A alta presión, más moléculas de gas se amontonan en el mismo volumen. Cualquier reacción que tenga lugar cuando uno de esos gases moléculas choca con otra molécula, por lo tanto, ocurrirá a un ritmo más rápido, debido a la mayor tasa de colisiones.
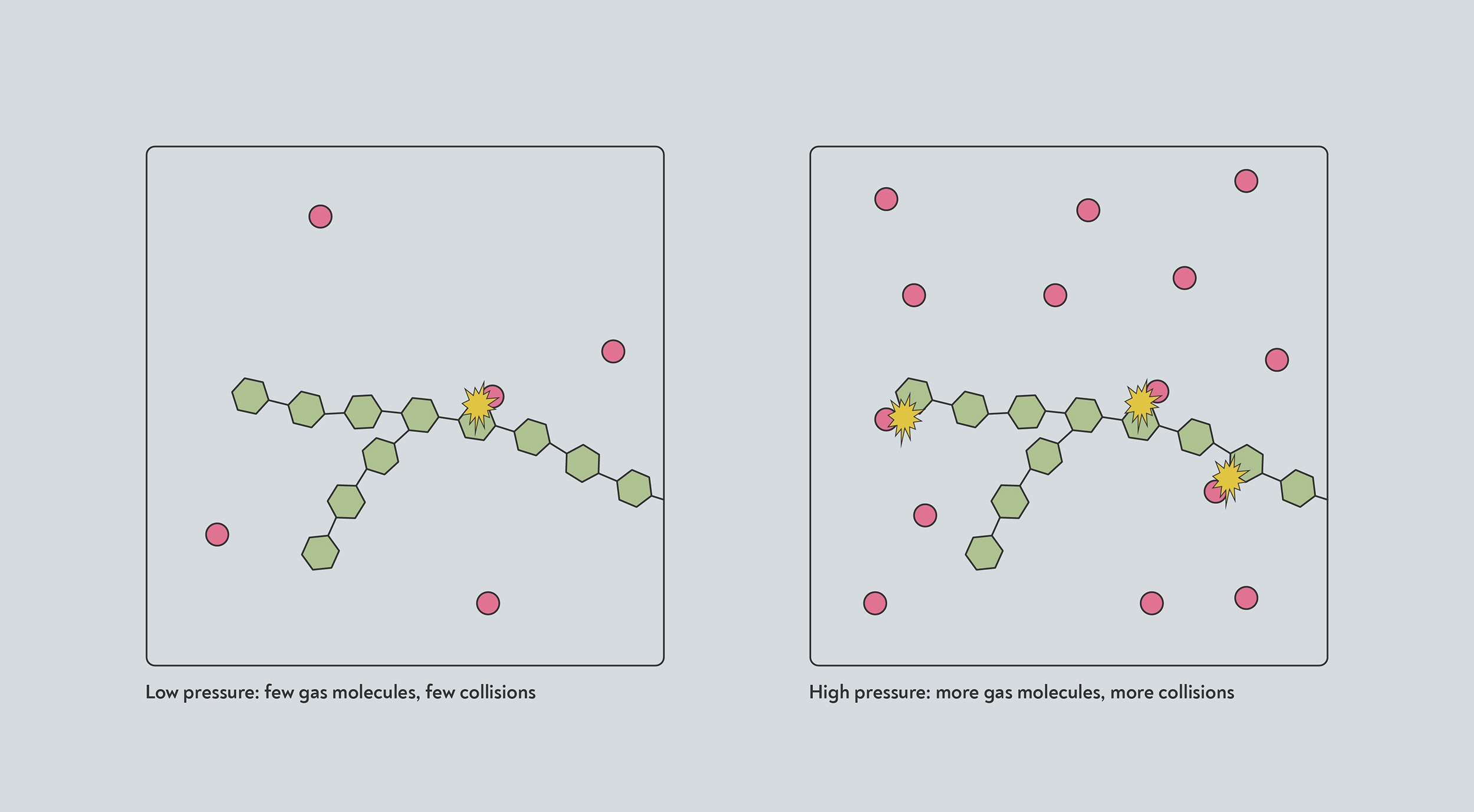 La alta presión aumenta la velocidad de muchas reacciones. A alta presión, más gas moléculas (rojo) ocupan la misma cantidad de espacio. Por lo tanto, es más probable que choquen con el sólido (azul) y desencadenen una reacción química.
La alta presión aumenta la velocidad de muchas reacciones. A alta presión, más gas moléculas (rojo) ocupan la misma cantidad de espacio. Por lo tanto, es más probable que choquen con el sólido (azul) y desencadenen una reacción química.
Otras reacciones pueden ser ralentizadas por la alta presión. Si un intermedio que se forma durante una reacción tiene un volumen mayor que los reactivos, entonces la alta presión dificulta la formación de ese intermedio, por lo tanto, disminuye la velocidad de reacción (Chen et al 2017). Por otro lado, si el intermedio tiene un volumen más pequeño, la alta presión puede aumentar la velocidad de reacción.
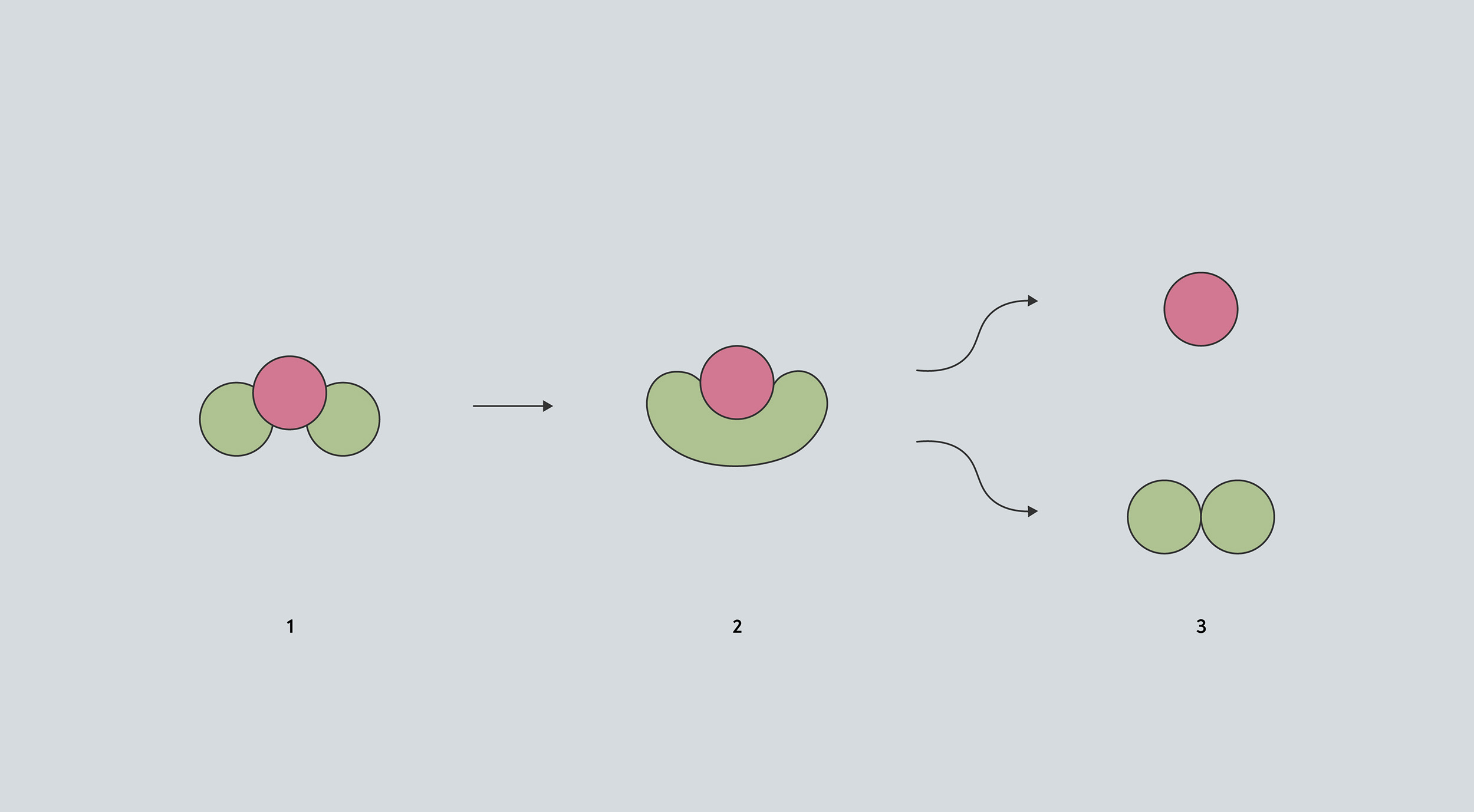 En este diagrama conceptual de una reacción, la molécula (1) debe pasar por una etapa intermedia (2) antes de poder descomponerse para formar otros compuestos (3). La etapa intermedia tiene un volumen mayor que la molécula original, por lo que la alta presión dificulta la formación de ese intermedio.
En este diagrama conceptual de una reacción, la molécula (1) debe pasar por una etapa intermedia (2) antes de poder descomponerse para formar otros compuestos (3). La etapa intermedia tiene un volumen mayor que la molécula original, por lo que la alta presión dificulta la formación de ese intermedio.
Lo importante de entender es que la presión aumenta la velocidad de la mayoría de las reacciones, pero algunas reacciones son inhibidas por la alta presión. La presión también puede inclinar el equilibrio de reacciones que están en equilibrio. vamos a explicar equilibrio reacciones en el Capítulo 5.